今回は、「質量数と原子量の関係と同位体と同素体の違い」についての説明です。
1.初めに
周期表では原子記号の左下に数字が表示されていて、あの数字は原子番号兼原子核に含まれる陽子の数を表しています。
なのですが、原子記号単体で見た時に、原子記号の左上にも数字がくっついていることがあります。
今回はこの数字に関連してくる用語たちについてまとめてみました。
2.質量数とは?
質量数とは、陽子の数と中性子の数を足し合わせた値のことです。
単位はありません。
陽子と中性子の個数のことなので“個”と数えてしまいそうになりますが、単位は無いのです。
あらゆる物質は原子という粒子で構成されています。
この原子は以下のような構造をしています。
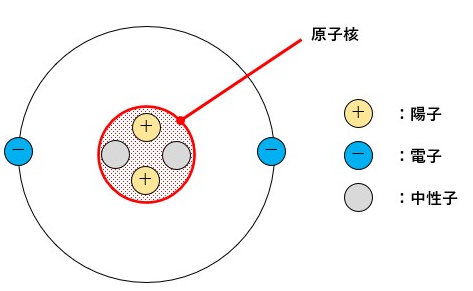
この陽子の数と中性子の数を足し合わせたものが質量数です。
原子記号は以下のようなルールで表示されます。

この左上に表示されている数字が質量数です。
ここで例に挙げた炭素原子Cの場合は、陽子の数が6個・中性子の数が6個だから質量数は12になっています。
なのですが、中性子の数が7個で質量数が13になる炭素原子も存在します。
このように、陽子の数は同じで中性子の数が異なる原子のことは同位体と呼びます。
この同位体が存在する比率は決まっているので、そこから導き出した原子の質量数の平均値のことを原子量と呼びます。
質量数と原子量は混同しやすい用語なので、注意しましょう。
3.同位体とは?
同位体[isotope]とは、陽子の数は同じで中性子の数が異なる原子のことです。
質量数の異なる原子だとも言えます。
図1の場合、陽子が2個・中性子が2個・電子が2個で構成された原子を指しています。
これに対して、陽子が2個・中性子が3個・電子が2個で構成された原子も存在します。
これらの原子のことを同位体と呼びます。
同位体同士では基本的な性質は同じなのですが、質量数が異なってきます。
陽子の数+中性子の数のことを質量数と呼ぶので、当たり前ではありますけどね。
図2に示した炭素原子の場合、陽子の数が6個なので、質量数(12)-陽子の数(6)=中性子の数(6)だとわかります。
これに対して、質量数(13)-陽子の数(6)=中性子の数(7)になったりする同位体も存在するんですね。
似たような名称の用語に同素体というものが存在しますが、指しているものは全く異なります。
4.同素体とは?
同素体[allotrope]とは、同じ元素から構成される単体の内、化学的・物理的な性質が異なる物質のことです。
化学的・物理的な性質とは、硬度・透明度・電気伝導性などです。
例としてよく挙げられるのは炭素です。
鉛筆やシャープペンの芯である黒鉛と鉱物であるダイヤモンドは、どちらも炭素元素から成ります。
黒鉛は色が黒いし脆いものですが、ダイヤモンドって透明度が高い上に硬いですよね。

他にも、炭素でできた繊維も存在します。
炭素繊維は柔らかく、折り曲げても破壊されることはありません。
とても同じ炭素元素で構成されているようには見えませんが、全て同じ元素が使われているんです。
このようなものを同素体と呼ぶわけです。
まあ、同じ“素”で作られているわけですよ。
同位体と似たような名称ですが、指しているものは全く違うでしょう?
5.原子量とは?
原子量とは、同位体が存在する比率から求めた原子の質量数の平均値のことです。
単位はありません。
図2で例に挙げた炭素原子の場合は、陽子の数が6個・中性子の数が6個だから質量数は12になっています。
なのですが、中性子の数が7個で質量数が13になる同位体の炭素原子も存在します。
この同位体が存在する比率は決まっていて、そこから導き出した原子の質量数の平均値のことを原子量と呼ぶわけです。
例えば、塩素原子には35Clと37Clという同位体が存在し、35Clは75%、37Clは25%という比率で存在します。
その為、塩素原子の原子量は、35×0.75+37×0.25=35.5となります。
以上、「質量数と原子量の関係と同位体と同素体の違い」についての説明でした。




